今受けている講義を元に僕が個人的にまとめた備忘録です。
よくわかってないところを整理する目的で書いているので、たくさん間違うと思います。
あやまりなどがあればどうぞご指摘ください。
はじめに、これから式を導出していくうえで必要となりそうな法則をいくつか認めておきます。
系に対して、熱力学的平衡を実現するような状態が存在する。
熱力学的な平衡状態とは、熱平衡、力学平衡、相平衡、化学平衡が実現されている状態である。
系がある状態1から状態2へ変化するとき、系の持っているエネルギーをそれぞれ
系が得た熱を
次のような式が成立する。
熱力学第1法則はエネルギー保存則を熱力学的に記述したものです。
以下の議論では上記2つを認めたものとして進めていきます。
開いた系とは系の流体(作動流体)が密閉されておらず、流れているような系のことです。
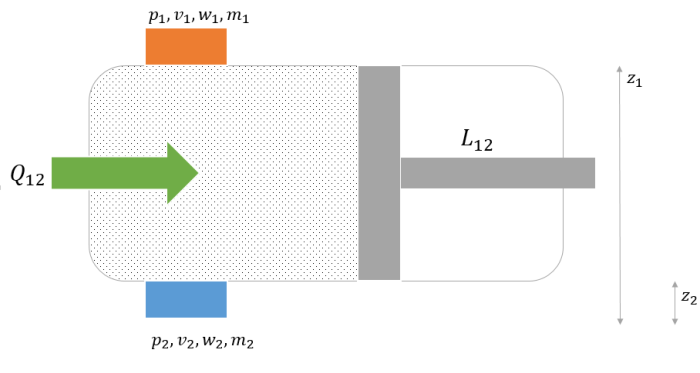
さて、開いた系の例として次のような装置を考えます。
は吸入弁と排出弁とピストンを持っており、それぞれの弁の高さは
とします。
内部の体積を、圧力を
とします。
また、のもつエネルギーを
とします。
において次のような過程を考えます。
これらは本来同時に起こっていますが、このように過程に分けて考えるほうがわかりやすいのでそのように考えることにします。
はじめは、吸入弁、排出弁ともに閉じているとします。
また、各過程においては熱力学的平衡状態が保たれているものとします。
過程1:吸入弁を開き、単位時間当たり圧力
過程2:熱を吸収させ、ピストンに仕事
をさせる。
過程3:排出弁を開き、単位時間当たり圧力、体積
、速さ
、質量
の作動流体を外部へ出す。 その後、排出弁を閉じる。
過程1、過程3があるのが閉じた系との違いです。これが時間的な作動流体の流入と流出を表しています。
装置の模式図を示しておきます。
さて、ここで系のエネルギーをについて考察しておきます。
装置に単位時間当たり圧力
、体積
、速度
、質量
の作動流体が高さ
から
流入してくるとします。(流出する場合は速度です)
このときは、装置内部の作動流体そのものの持つエネルギーを
として、重力加速度を
とすると、
装置内の作動流体が受ける仕事、流入する作動流体の運動エネルギーと位置エネルギーを考慮して、
と表せます。
ここで、作動流体の運動エネルギーと位置エネルギーの項\frac{mw^2}{2}+mgzは、装置がとてつもなく大きくない限り、他の項に対
して非常に小さくなるので、無視することができます。
これは実際に例を作って計算して比べて見ればわかります。例えば0度の水を100度にするために必要なエネルギーで、
高度一万メートル以上の高さにその水を持ち上げることができます。装置はそんなに大きくはありません。
よって、と置くことによって、
とすることができます。は過程1、3における作動流体の内部エネルギ―です。
このように定めたをエンタルピーといいます。
さて過程1、過程3におけるのエネルギーをそれぞれ
とすると、
熱力学第1法則より
が成り立ちます。
エンタルピーを用いて書き換えると
が成立します。
さて系が行う仕事としてすべてを捉えた場合、ピストンのする仕事に加えて、
流出入に際して仕事を系は外部に行っているといえます。
したがって、外部にした正味の仕事をとすれば、
(定義式)から、
とできて、これはグラフにおける面積を考えることによって
がいえます。
開いた系において、系が外部にした仕事を考える場合には、内部エネルギーに加えて、
閉じた系における仕事(絶対仕事)ではなく、
(工業仕事)を考えたほうが都合がよいです。
もちろん工業仕事は本来の仕事の定義とは外れていますので、便宜的にそのような名前がついているだけです。
絶対仕事、工業仕事
を用いると
閉じた系、開いた系において熱力学第一法則をそれぞれ次のように記述することができます。
[閉じた系に対する熱力学第1法則] :
[開いた系に対する熱力学第1法則] :